Composé du lithiumProduit chimique corrosifOxyde
projets correspondantscomposé chimiqueformulehydroxyde de lithiumlithiumoxygèneeaufluorure de calciumthéorie VSEPRH2Operoxyde de lithiumsilice
Cet article est une ébauche concernant les composés inorganiques.Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
Oxyde de lithium
|
 |
| Identification |
|---|
Synonymes
|
lithine, oxyde de lithine
|
|---|
No CAS
|
12057-24-8
|
|---|
NoECHA
|
100.031.823 |
|---|
No CE
|
235-019-5
|
|---|
Apparence
|
poudre
|
|---|
| Propriétés chimiques |
|---|
Formule brute
|
Li2O [Isomères]
|
|---|
Masse molaire[1] |
29,881 ± 0,004 g/mol
Li 46,46 %, O 53,54 %,
|
|---|
| Propriétés physiques |
|---|
T° fusion
|
1 570 °C
|
|---|
Solubilité
|
Hydrolyse violente en LiOH
|
|---|
Masse volumique
|
2 013 kg·m-3
|
|---|
| Cristallographie |
|---|
Symbole de Pearson
|
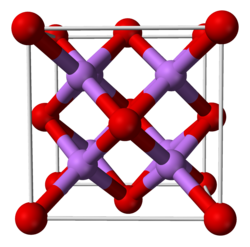
cF12displaystyle cF12, [2] [2] |
|---|
Classe cristalline ou groupe d’espace
|
Fm3m (n°225) [2] |
|---|
Strukturbericht
|
C1[2] |
|---|
Structure type
|
CaF2[2] |
|---|
| Précautions |
|---|
SIMDUT[3] |
|---|

E,
E : Matière corrosive
forme au contact de l'eau une substance corrosive : hydroxyde de lithium
Divulgation à 1,0% selon les critères de classification
|
| Directive 67/548/EEC |
|---|
 C
Symboles :
C : Corrosif
Phrases R :
R34 : Provoque des brûlures.
Phrases S :
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste.
S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette).
S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage.
Phrases R : 34,
Phrases S : 26, 36/37/39, 45,
|
|
| Unités du SI et CNTP, sauf indication contraire. |
modifier  |
L'oxyde de lithium est un composé chimique de formule Li2O. Il se forme avec de petites quantités d'hydroxyde de lithium LiOH lorsque le lithium métallique brûle dans l'air et se combine avec l'oxygène et l'eau atmosphériques :
- 4 Li + O2 → 2 Li2O
- 4 Li + 2 H2O + O2 → 4 LiOH
L'oxyde de lithium présente à l'état solide une structure cristalline de type antifluorine, c'est-à-dire une structure calquée sur celle du fluorure de calcium CaF2 mais où les cations et les anions y jouent le rôle opposé. À l'état gazeux fondamental, la molécule Li2O est linéaire, contrairement aux résultats prévus par la théorie VSEPR (d'après laquelle la molécule Li2O devrait avoir la même forme que la molécule d'H2O), ce qui est cohérent avec une géométrie gouvernée par les liaisons ioniques.
Li2O résulte de la décomposition thermique du peroxyde de lithium Li2O2 et attaque la silice à température élevée.
Références |
↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
↑ a b c et d« The Fluorite (C1) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le 17 décembre 2009)
↑ « Oxyde de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Composés du lithium
|
|---|
| Inorganiques |
.mw-parser-output .sep-listefont-weight:bold
LiAlCl4 · LiAlH4 · LiAlO2 · LiBF4 · LiBH4 · LiBO2 · LiB3O5 · LiBr · LiCl · LiClO · LiClO3 · LiClO4 · LiCoO2 · LiF · LiH · LiI · LiNH2 · Li2NH · LiN3 · LiNO2 · LiNO3 · LiNbO3 · LiOH · LiO2 · LiO2H · Li2O2 · LiPF6 · LiTaO3 · Li2B4O7 · LiHCO3 · Li2CO3 · Li2C2 · Li2MoO4 · Li2O · Li2S · Li2SO3 · Li2SO4 · Li2SO4.H2O · Li2Po · Li2TiO3 · Li3N
|
|---|
| Organiques |
acétate · citrate · diisopropylamide · orotate · succinate · stéarate · organolithiens
|
|---|
| Minéraux |
Amblygonite · Elbaïte · Eucryptite · Jadarite · Lépidolite · Lithiophilite · Pétalite · Pezzottaïte · Saliotite · Spodumène · Sugilite · Tourmaline · Zabuyelite · Zinnwaldite
|
|---|
Oxydes
|
|---|
| États divers |
Tétroxyde d'antimoine (Sb2O4) · Oxyde d'argent(I,III) (AgO) · Oxyde de cobalt(II,III) (Co3O4) · Oxyde de fer(II,III) (Fe3O4) · Oxyde de manganèse(II,III) (Mn3O4) · Oxyde de plomb(II,IV) (Pb3O4)
|
|---|
| État d'oxydation +1 |
Oxyde d'argent (Ag2O) · Monoxyde de dicarbone (C2O) · Oxyde de cuivre(I) (Cu2O) · Monoxyde de dichlore (Cl2O) · Oxyde de lithium (Li2O) · Oxyde de potassium (K2O) · Oxyde de sodium (Na2O) · Oxyde de rubidium (Rb2O) · Oxyde de thallium(I) (Tl2O) · Eau (H2O) et autres oxydes d'hydrogène
|
|---|
| État d'oxydation +2 |
Oxyde d'aluminium(II) (AlO) · Oxyde de baryum (BaO) · Oxyde de béryllium (BeO) · Oxyde de cadmium (CdO) · Oxyde de calcium (CaO) · Monoxyde de carbone (CO) · Oxyde de cobalt(II) (CoO) · Oxyde de chrome(II) (CrO) · Oxyde de cuivre(II) (CuO) · Monoxyde de germanium (GeO) · Oxyde de fer(II) (FeO) · Monoxyde d'iridium (IrO) · Oxyde de magnésium (MgO) · Oxyde de mercure(II) (HgO) · Oxyde de nickel(II) (NiO) · Monoxyde d'azote (NO) · Oxyde de palladium(II) (PdO) · Oxyde de plomb(II) (PbO) · Oxyde de strontium (SrO) · Monoxyde de soufre (SO) · Dioxyde de disoufre (S2O2) · Oxyde d'étain(II) (SnO) · Oxyde de titane(II) (TiO) · Oxyde de vanadium(II) (VO) · Oxyde de zinc (ZnO) · Monoxyde de zirconium (ZrO)
|
|---|
| État d'oxydation +3 |
Sesquioxyde d'actinium (Ac2O3) · Oxyde d'aluminium (Al2O3) · Trioxyde d'antimoine (Sb2O3) · Trioxyde d'arsenic (As2O3) · Oxyde de bismuth(III) (Bi2O3) · Trioxyde de bore (B2O3) · Oxyde de chrome(III) (Cr2O3) · Trioxyde de diazote (N2O3) · Oxyde d'erbium(III) (Er2O3) · Oxyde d'europium(III) (Eu2O3) · Oxyde de fer(III) (Fe2O3) · Oxyde de gadolinium(III) (Gd2O3) · Oxyde de gallium(III) (Ga2O3) · Oxyde d'holmium(III) (Ho2O3) · Oxyde d'indium(III) (In2O3) · Oxyde d'iridium(III) (Ir2O3) · Oxyde de lanthane (La2O3) · Oxyde de lutécium(III) (Lu2O3) · Oxyde de néodyme(III) (Nd2O3) · Oxyde de nickel(III) (Ni2O3) · Trioxyde de phosphore (P4O6) · Oxyde de prométhium(III) (Pm2O3) · Oxyde de praséodyme(III) (Pr2O3) · Oxyde de rhodium(III) (Rh2O3) · Oxyde de samarium(III) (Sm2O3) · Oxyde de scandium (Sc2O3) · Oxyde de terbium(III) (Tb2O3) · Oxyde de thallium(III) (Tl2O3) · Oxyde de thulium(III) (Tm2O3) · Oxyde de titane(III) (Ti2O3) · Oxyde de tungstène(III) (W2O3) · Oxyde de vanadium(III) (V2O3) · Oxyde d'ytterbium(III) (Yb2O3) · Oxyde d'yttrium(III) (Y2O3)
|
|---|
| État d'oxydation +4 |
Dioxyde de carbone (CO2) · Trioxyde de carbone (CO3) · Oxyde de cérium(IV) (CeO2) · Dioxyde de chlore (ClO2) · Dioxyde de chrome (CrO2) · Peroxyde d'azote (N2O4) · Dioxyde de germanium (GeO2) · Oxyde d'hafnium(IV) (HfO2) · Oxyde d'iridium(IV) (IrO2) · Dioxyde de plomb (PbO2) · Dioxyde de manganèse (MnO2) · Dioxyde d'azote (NO2) · Oxyde de neptunium(IV) (NpO2) · Oxyde de protactinium(IV) (PaO2) · Dioxyde de plutonium (PuO2) · Oxyde de rhodium(IV) (RhO2) · Dioxyde de ruthénium (RuO2) · Dioxyde de sélénium (SeO2) · Dioxyde de silicium (SiO2) · Dioxyde de soufre (SO2) · Dioxyde d'étain (SnO2) · Dioxyde de tellure (TeO2) · Dioxyde de thorium (ThO2) · Dioxyde de titane (TiO2) · Oxyde de tungstène(IV) (WO2) · Dioxyde d'uranium (UO2) · Oxyde de vanadium(IV) (VO2) · Dioxyde de zirconium (ZrO2)
|
|---|
| État d'oxydation +5 |
Pentoxyde d'antimoine (Sb2O5) · Pentoxyde d'arsenic (As2O5) · Pentoxyde d'azote (N2O5) · Pentoxyde de niobium (Nb2O5) · Pentoxyde de phosphore (P2O5) · Oxyde de protactinium(V) (Pa2O5) · Oxyde de tantale(V) (Ta2O5) · Oxyde de vanadium(V) (V2O5)
|
|---|
| État d'oxydation +6 |
Trioxyde de chrome (CrO3) · Trioxyde d'iridium (IrO3) · Trioxyde de molybdène (MoO3) · Trioxyde de rhénium (ReO3) · Trioxyde de sélénium (SeO3) · Trioxyde de soufre (SO3) · Trioxyde de tellure (TeO3) · Trioxyde de tungstène (WO3) · Trioxyde d'uranium (UO3) · Trioxyde de xénon (XeO3)
|
|---|
| État d'oxydation +7 |
Heptoxyde de dichlore (Cl2O7) · Heptoxyde de dimanganèse (Mn2O7) · Oxyde de rhénium(VII) (Re2O7) · Oxyde de technétium(VII) (Tc2O7)
|
|---|
| État d'oxydation +8 |
Tétroxyde d'osmium (OsO4) · Tétroxyde de ruthénium (RuO4) · Tétraoxyde de xénon (XeO4) · Oxyde d'iridium(VIII) (IrO4) · Tétroxyde d'hassium (HsO4)
|
|---|
| Sujets connexes |
Oxyde de carbone · Oxyde de chlore · Protoxyde · Oxoacide · Ozonure
|
|---|
 Portail de la chimie
Portail de la chimie



